Riduzione graduale del trattamento con antidepressivi serotoninergici (SSRI) per attenuare i sintomi di astinenza
Mark Abie Horowitz, David Taylor, Lancet Psychiatry 2019; 6: 538-46, Traduzione di Marcello Macario, Giacinto Buscaglia, Anna Gastaldi e Claudia Riccio, Pubblicato online 5 marzo 2019, https://doi.org/10.1016/S2215-0366(19)30032-X
Prince of Wales Hospital, Sydney, NSW, Australia (M A Horowitz PhD);
Health and Environment Action Lab, London, UK (M A Horowitz);
Institute of Pharmaceutical Science, King’s College London, London, UK (Prof D Taylor PhD)
Corrispondenza:
Dr Mark Abie Horowitz, Prince of Wales Hospital, Sydney, NSW 2031, Australia
mark_horo@hotmail.com
Tutte le classi di farmaci prescritti per il trattamento della depressione sono associate con sindromi da sospensione. La sindrome da astinenza da SSRI si verifica spesso e può essere grave, sino a costringere i pazienti a riprendere la terapia antidepressiva. Sebbene la sindrome da astinenza possa essere distinta dalla ricomparsa del disturbo originario, potrebbe anche essere confusa con esso, inducendo a ricorrere a inutili cure a lungo termine. Le linee guida raccomandano brevi periodi di riduzione graduale, tra le 2 e le 4 settimane, fino ad arrivare alle minime dosi terapeutiche o alla metà di queste dosi, prima della completa sospensione. Gli studi hanno dimostrato che tali riduzioni progressive presentano benefici minimi rispetto all’interruzione improvvisa e spesso non sono tollerate dai pazienti. Riduzioni di dosaggio realizzate nell’arco di mesi e fino a dosi molto più basse delle dosi terapeutiche minime hanno mostrato maggiore successo nel ridurre i sintomi di astinenza. Altri tipi di farmaci associati all’astinenza, come le benzodiazepine, sono scalati gradualmente per ridurre il loro effetto biologico sui recettori e minimizzare i sintomi di astinenza. Queste riduzioni del dosaggio vengono realizzate con programmi di riduzione esponenziale che raggiungono dosi molto piccole. Questo metodo potrebbe essere utile per la riduzione degli SSRI. Abbiamo esaminato le immagini PET relative alla occupazione dei recettori della serotonina da parte di SSRI ed abbiamo scoperto che la riduzione iperbolica delle dosi di SSRI riduce il loro effetto sul blocco dei recettori della serotonina in modo lineare. Pertanto suggeriamo che gli SSRI debbano essere ridotti iperbolicamente e lentamente fino a dosi molto più basse di quelle minime terapeutiche, analogamente alle strategie di riduzione per altri farmaci che causano sintomi di astinenza. In questo modo i sintomi di astinenza saranno ridotti al minimo.
Introduzione
Molti farmaci sono associati alla sindrome da astinenza, più comunemente quelli che agiscono sul sistema cardiovascolare e sul SNC. (1) Tutte le principali classi di antidepressivi – inibitori delle monoamino ossidasi, antidepressivi triciclici, SSRI e SNRI – sono associati a sintomi da astinenza quando vengono sospesi. (2,3). Il termine “ sindrome da interruzione” è stato coniato per riferirsi alla sindrome da astinenza da antidepressivi. (4) La sindrome da interruzione degli SSRI, come indicato nel DSM-5 (5) e descritto nella checklist dei “Segni e Sintomi di Sospensione” (6), comprende una vasta gamma di sintomi somatici e psicologici (figura 1).
 I sintomi di astinenza da SSRI possono, in parte, assomigliare ai sintomi di ansia o depressione per i quali il farmaco è stato originariamente prescritto. (5) Tuttavia, la sindrome da astinenza può essere distinta da una ricaduta o recidiva del disturbo originale per la sua rapidità di insorgenza (giorni anziché settimane), (3,7,8) per la risposta rapida alla reintroduzione degli SSRI (generalmente entro poche ore, comunque entro qualche giorno) (3,7,9) e per la presenza di sintomi somatici e psicologici abbastanza diversi da quelli della malattia originale (compreso vertigini, nausea e sensazioni simili allo shock. (7,10) La sindrome da astinenza può essere erroneamente diagnosticata come recidiva depressiva, portando ad un trattamento prolungato per pazienti che potrebbero non averne bisogno, (11–13)ma non è chiaro con quale frequenza ciò accada. (14)
I sintomi di astinenza da SSRI possono, in parte, assomigliare ai sintomi di ansia o depressione per i quali il farmaco è stato originariamente prescritto. (5) Tuttavia, la sindrome da astinenza può essere distinta da una ricaduta o recidiva del disturbo originale per la sua rapidità di insorgenza (giorni anziché settimane), (3,7,8) per la risposta rapida alla reintroduzione degli SSRI (generalmente entro poche ore, comunque entro qualche giorno) (3,7,9) e per la presenza di sintomi somatici e psicologici abbastanza diversi da quelli della malattia originale (compreso vertigini, nausea e sensazioni simili allo shock. (7,10) La sindrome da astinenza può essere erroneamente diagnosticata come recidiva depressiva, portando ad un trattamento prolungato per pazienti che potrebbero non averne bisogno, (11–13)ma non è chiaro con quale frequenza ciò accada. (14)
I sintomi di astinenza da SSRI si verificano in molti pazienti, con un’incidenza che varia dal 42% al 100% per la paroxetina, (6,15-18) e dal 9% al 77% per la fluoxetina, (6,15,17,18) con un tasso medio del 53,6% per tutti gli SSRI in 14 studi che hanno esaminato la sospensione di antidepressivi. (13) L’incidenza e la gravità sembrano essere influenzate dalla emivita e dall’affinità recettoriale, dalla durata e dalla dose del trattamento, dal metodo di riduzione e dalle caratteristiche individuali del paziente (e tra queste, potenzialmente, vi sono anche gli effetti di anticipazione). (3,9,19) Una revisione sistematica ha identificato cinque studi che hanno valutato la gravità dei sintomi di astinenza; in questi studi quasi la metà dei partecipanti che aveva avuto sintomi di astinenza li ha descritti scegliendo l’opzione più estrema nella scala presentata loro per descrivere la gravità di tali effetti. (13) Nei 14 giorni dopo la cessazione vi è anche un aumento del 60% dei tentativi di suicidio rispetto ai pazienti che continuano a utilizzare antidepressivi (possiamo quindi attribuire l’aumento del rischio all’astinenza piuttosto che al mancato trattamento). (20)
La sindrome da astinenza da SSRI può durare sostanzialmente più a lungo rispetto al periodo di 1–2 settimane (13)che è stato in precedenza menzionato. (4) In uno studio, i sintomi di astinenza sono durati in media fino a 6 settimane, e un quarto dei pazienti ha riferito sintomi che sono durati più di 12 settimane. (18) Un altro studio ha riportato che per l’86,7% degli intervistati, la sindrome era durata almeno 2 mesi; per il 58,6% era durata almeno 1 anno e per il 16,2% era durata più di 3 anni. (21) Casi cinici identificano dei sintomi che durano per un anno o più. (22,23)
L’uso sempre più a lungo termine di SSRI (quasi la metà dei pazienti nel Regno Unito che assumono antidepressivi -di solito SSRI- lo fanno per più di 2 anni) (19,24) nasce in parte perché i pazienti non sono disposti a smettere a causa degli effetti negativi della sindrome da astinenza, (19,25) e per le poche informazioni su come mitigare tale sindrome. (19,25) I medici ritengono che non ci siano abbastanza indicazioni su come procedere per l’interruzione della terapia antidepressiva. (19)
Ridurre gli SSRI
Le linee guida raccomandano un breve periodo di riduzione graduale degli SSRI, piuttosto che una brusca interruzione, per evitare sintomi di astinenza. il National Institute for Health and Care Excellence, (26) la British Association for Psychopharmacology, (12) la Monthly Index of Medical Specialities, (27) e UpToDate (28) suggeriscono periodi di riduzione compresi tra 2 settimane e 4 settimane, con riduzioni lineari della dose fino alla dose terapeutica minima o metà della dose terapeutica minima, prima della cessazione completa. Queste linee guida suggeriscono che la fluoxetina non richiede una riduzione graduale, (28) o che, se assunta a dosi elevate, potrebbe essere ridotta in 2 settimane. (27) Secondo una revisione sistematica, le informazioni fornite dalle case farmaceutiche sono risultate “vaghe e non specifiche”. (29)
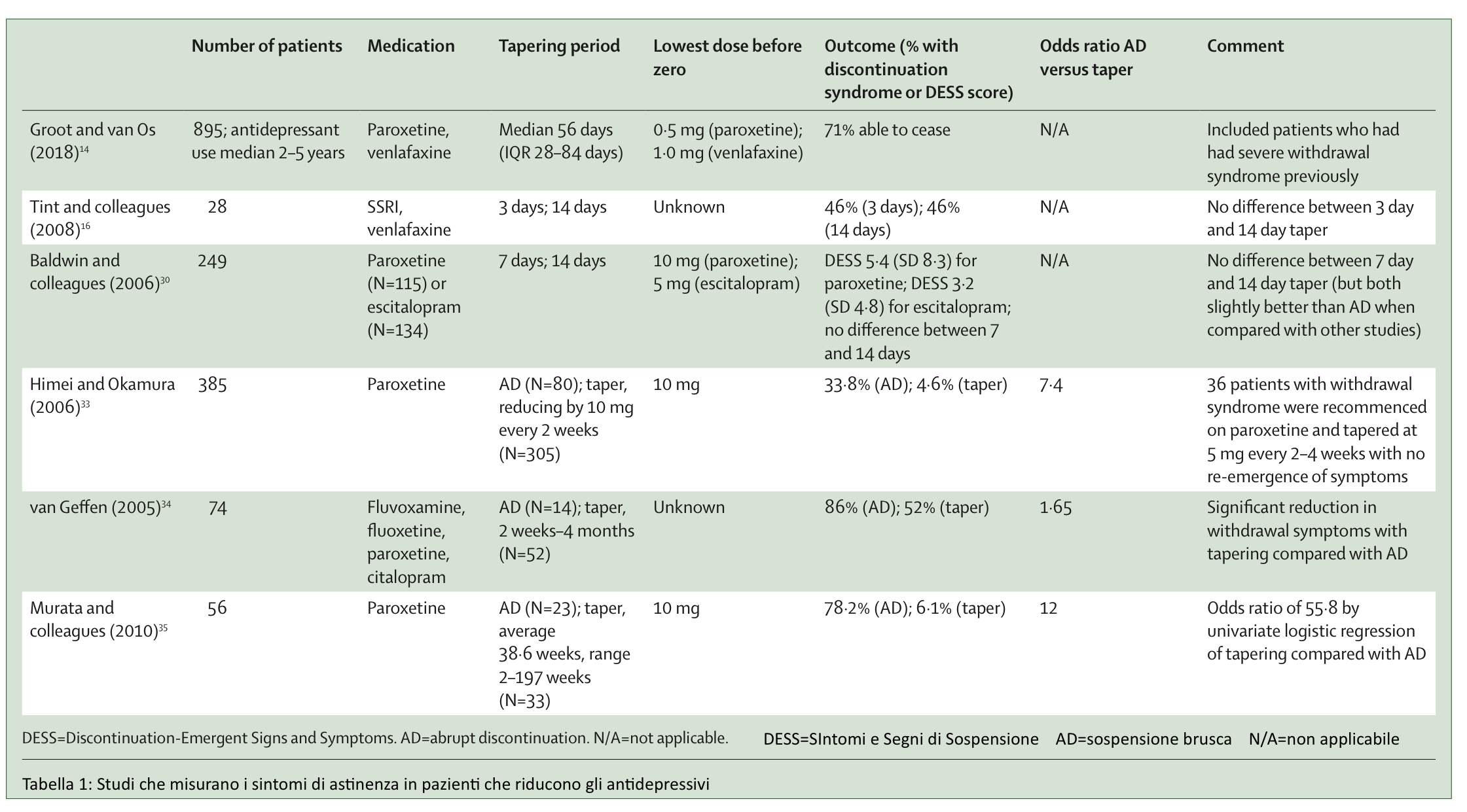
Studi randomizzati che consideravano periodi di riduzione fino a 14 giorni hanno mostrato che l’attenuazione della gravità dei sintomi di astinenza rispetto alla interruzione brusca (31) non vi era del tutto (16) o era minima (30) della gravità dei sintomi di astinenza rispetto alla brusca interruzione. Questi studi hanno portato alla conclusione che sono necessari strategie di riduzione più prolungate nel tempo. (3,32) In effetti, gli studi che utilizzano periodi di riduzione lunghi mesi (33–35) hanno mostrato risultati migliori (tabella 1). In uno studio, la riduzione della paroxetina di 10 mg ogni 2 settimane ha ridotto l’incidenza di astinenza dal 33,8% al 4,6%. (33) In questo studio i pazienti che presentavano sintomi di astinenza sono stati trattati nuovamente con il farmaco, che poi è stato ridotto di 5 mg ogni 2–4 settimane e questo ha permesso di evitare i sintomi da astinenza. (33) In un altro studio, i pazienti che hanno ridotto la dose di SSRI durante un periodo fino a 4 mesi hanno avuto 5,1 eventi di “Sintomi e Segni di Sospensione” rispetto a 11,7 eventi dei pazienti che hanno interrotto bruscamente. (34) In un altro studio con paroxetina, i pazienti che hanno ridotto la dose in un periodo lungo in media 38,6 settimane (intervallo, 2–197 settimane), di durata adattata all’individuo, hanno avuto un’incidenza del 6,1% della sindrome da astinenza, rispetto a 78,2 % dei pazienti che avevano interrotto improvvisamente (tabella 1). (35) Le strisce per la riduzione degli antidepressivi (tapering strips), che riducono il farmaco a piccole frazioni della dose terapeutica minima (ad es. 0,5 mg per paroxetina e citalopram), presentano risultati favorevoli; Il 71% di 895 pazienti, il 97% dei quali aveva avuto in precedenza sintomi di astinenza, è stato in grado di interrompere il trattamento in un periodo medio di 56 giorni (scarto interquartile 28–84 giorni). (14) Anche diversi studi clinici supportano la migliore efficacia di una riduzione più lenta. (36-38) In un caso limite, sono stati necessari a un uomo diversi mesi di riduzione per arrivare a una dose media di 6,25 mg di sertralina al giorno ed evitare i sintomi di astinenza, tra i quali vi era l’ipotensione ortostatica (che essendo misurabile ha consentito una valutazione obiettiva dell’astinenza). (36)
Due studi del 2018 confermano che gli schemi di riduzione più brevi, come consigliato dalle linee guida, non sono efficaci. Uno studio ha rilevato che non è possibile la riduzione della dose in un periodo di 4 settimane, con il 60% dei pazienti (51 su 85) che hanno ridotto la durata dei loro farmaci in 4 mesi. (39) Un altro studio che ha utilizzato in prevalenza riduzioni lineari, con dosi finali pari alle dosi terapeutiche minime (o alla metà di queste) ha rilevato che solo il 37% dei pazienti (26 su 71) è stato in grado di interrompere la terapia. (40) Un ampio studio condotto su 400 pazienti ha mostrato un rischio significativamente più basso di ricaduta se gli antidepressivi venivano gradualmente ridotti (> 14 giorni) anziché rapidamente (1–7 giorni). (41)
Neurobiologia della sospensione e sua gestione
La strategia di riduzione degli SSRI si basa sul razionale secondo cui se i sistemi biologici hanno più tempo per adattarsi alle riduzioni del legando disponibile, si riduce anche l’intensità dei sintomi di astinenza. (3,12,32,42) I recettori attivati da un farmaco sono spesso sottoregolati o presentano una sensibilità ridotta per mantenere l’omeostasi. (43) La brusca sospensione del farmaco disturba l’equilibrio omeostatico, con conseguente riduzione della stimolazione (del recettore), che si manifesta con sintomi di astinenza che sono spesso di natura opposta all’effetto originale del farmaco. (43) Ad esempio, la sindrome da astinenza da antidepressivi triciclici, che hanno forti azioni anticolinergiche, è caratterizzata da effetti colinergici. (44) L’adattamento al farmaco è più probabile in caso di uso a lungo termine e ad alte dosi. (45,46) I farmaci a emivita più breve producono sintomi di astinenza con maggiore incidenza, maggiore gravità e insorgenza più rapida rispetto ai farmaci a emivita più lunga, probabilmente perché la loro sospensione è associata a una riduzione più rapida della quantità di ligando disponibile. (45,47,48) I sintomi di astinenza possono di solito essere eliminati dalla reintroduzione del farmaco sospeso, riportando il sistema in equilibrio omeostatico. (43)
L’approccio principale per mitigare i sintomi di astinenza è quello di ridurre la velocità con cui questo equilibrio viene interrotto, lasciando più tempo per l’adattamento del sistema a livelli bassi di ligando, limitando così i sintomi di astinenza a una gravità tollerabile. (45) Questo risultato si può ottenere sia sostituendo un farmaco a lunga emivita con uno a emivita più breve prima della riduzione che riducendo molto lentamente la dose di un farmaco con una breve emivita. (45,48)
In particolare, la riduzione della dose dei farmaci per quantità costanti (diminuzione lineare) tende a causare effetti collaterali sempre più gravi nel tempo. (45,48,49) Questo effetto è probabilmente una conseguenza della relazione iperbolica dose-risposta tra un farmaco e un recettore, secondo la legge dell’azione di massa, (50) come avviene tipicamente per l’effetto del diazepam sul suo recettore bersaglio, l’acido gamma-aminobutirrico A (GABA-A, figura 2A). Di conseguenza, le raccomandazioni sullo scalaggio delle benzodiazepine consigliano riduzioni sempre più piccole del dosaggio quando ci si avvicina allo zero, (45,48,49) in altre parole “fermati lentamente man mano che scendi” (stop slow as you go low). (1)
Le linee guida per scalare le benzodiazepine raccomandano riduzioni della dose proporzionali alla dose attuale (più comunemente riduzioni del 10%), somministrando quindi dosi esponenzialmente decrescenti invece di fare delle riduzioni lineari. (45,49,52) Ad esempio, la riduzione del 10% alla settiamana del Diazepam partendo da una dose di 20 mg comporterebbe una riduzione di 2 mg nella prima settimana. La riduzione cumulativa della seconda settimana sarebbe di 3,8 mg (un’ulteriore riduzione di 1,8 mg), la riduzione cumulativa della terza settimana sarebbe di 5,42 mg (un ulteriore riduzione di 1,62 mg) e così via (figura 2B). Questi metodi di diminuzione esponenziale producono riduzioni approssimativamente lineari di effetto sul recettore target. Le riduzioni continuano anche quando si è arrivati a dosi ben al di sotto della dose terapeutica minima (che potrebbe apparire minuscola) prima della completa interruzione. Lo scopo di questo metodo è di evitare l’effetto sul recettore bersaglio che cresce man mano che scende la dose di farmaco. Ad esempio, la dose finale di diazepam raccomandata dalle linee guida sulla riduzione è di 1 mg (45) (equivalente al 4% di occupazione del recettore GABA-A). (52)
Poiché si ritiene che i sintomi di astinenza diminuiscano a causa degli adattamenti omeostatici a livelli ridotti di terapia, si raccomanda una pausa tra le riduzioni della dose. (45,48,49) Poiché non conosciamo i tempi esatti di questi adattamenti, la maggior parte delle linee guida per la sospensione sono state sviluppate sulla base dell’esperienza clinica; una consensus conference suggerisce di attendere 1–4 settimane tra le riduzioni della dose, per consentire la risoluzione dei sintomi di astinenza. (45,48) La maggior parte delle linee guida raccomanda l’individualizzazione di questo processo, data la variabilità dell’adattamento ai cambiamenti del dosaggio del farmaco e, di conseguenza, della gravità e della durata dei sintomi di astinenza. (45,48)
Caratteristiche farmacologiche dell’astinenza da SSRI
La sindrome da astinenza o sospensione da SSRI ha gli stessi determinanti descritti in precedenza. I sintomi da astinenza sono più comuni quando gli SSRI sono somministrati in dosi elevate, (53,54) o per lunghi periodi. (53)Farmaci con emivita più breve, come la paroxetina, producono sintomi di astinenza con maggiore incidenza, (6,15-18)con insorgenza più rapida, (6,15-18) e con gravità maggiore (6,15-18) rispetto a farmaci con emivita più lunga, come la fluoxetina. (6,15,17,18) La paroxetina induce sintomi di astinenza in 2 giorni (55) mentre i sintomi di astinenza da fluoxetina possono manifestarsi tra le 2 e le 6 settimane. (9,56)
Come con la sospensione di altri farmaci, la comparsa degli effetti di astinenza è correlata ad una riduzione percentuale della concentrazione plasmatica. (55) Livelli plasmatici più alti di SSRI prima della cessazione (57) e subito dopo essa (58) sono predittivi di sintomi di astinenza più gravi. La reintroduzione del SSRI interrotto, generalmente risolve i sintomi entro 24 ore. (3) Sono stati tentati approcci per diminuire i sintomi di astinenza: la riduzione graduale degli SSRI, (9,12) o la sostituzione con SSRI ad emivita più lunga -fluoxetina- (3,12) secondo gli approcci utilizzati per la sospensione di altri farmaci. Si ritiene che i fattori individuali, compresa la genetica (35)svolgano un ruolo significativo nel determinare gli effetti di astinenza.
Neurobiologia dell’astinenza da SSRI
Si pensa che gli SSRI producano il loro effetto attraverso una fase iniziale di inibizione del trasportatore della serotonina, portando così ad un aumento dei livelli sinaptici di serotonina, producendo così risposte aumentate dei recettori serotoninergici. (59,60) I neuroni serotoninergici modulano anche altri sistemi di neurotrasmettitori, compresa la noradrenalina, la dopamina e il GABA. (47) Effetti sulla neurogenesi, un’azione infiammatoria, effetti sull’asse ipotalamo-ipofisi-surrene, conseguenze a valle delle azioni serotonergiche; tutto questo viene anche ipotizzati per spiegare gli effetti antidepressivi degli SSRI. (59,61,62) Sebbene i dettagli rimangano indefiniti, l’astinenza da SSRI è stata attribuita a una relativa carenza di serotonina nel contesto dell’adattamento diffuso dei recettori serotonergici. (9,47,63) Il trattamento con SSRI ha dimostrato di ridurre la densità dei recettori serotonergici nei ratti . (64) È stato inoltre dimostrato nell’uomo che anche la somministrazione di SSRI per un breve periodo riduce la sensitività del recettore corticale 2A per la 5-idrossitriptamina (65) e del recettore 4 per la 5-idrossitriptamina (66)
L’inversione degli effetti sui neurotrasmettitori che sono indirettamente influenzati dagli SSRI, noradrenalina, glutammato e GABA tra gli altri, potrebbe anche svolgere un ruolo nell’astinenza da SSRI. (9,47,63)
Il ruolo della serotonina nel coordinamento delle funzioni sensoriali e del sistema nervoso autonomo con l’attività motoria potrebbe essere collegato con la sindrome da astinenza da SSRI. (42) Una ridotta stimolazione del recettore 1A per la 5-idrossitriptamina nel nucleo del rafe, noto per essere coinvolto nelle cinetosi, si ritiene sia correlata a vertigini, nausea e letargia nella sindrome da astinenza. (47) La disregolazione delle funzioni somato-sensoriali potrebbe provocare parestesie, mentre i disturbi del movimento (ad es. la distonia) potrebbero essere dovuti all’alterata funzione dopaminergica. (47)
Alcuni aspetti della sindrome da astinenza da SSRI potrebbero anche essere attribuiti a cambiamenti neuronali in tessuti diversi dal cervello, data la presenza di recettori serotonergici in tessuti quali il sistema vascolare e l’intestino. (67)
Principi farmacologici della riduzione degli SSRI
Come in altre sindromi da astinenza, una riduzione razionale delle dosi di SSRI comporterà riduzioni graduali nella loro azione sui trasportatori di serotonina, il loro principale recettore. (59) Studi realizzati con la PET in cui un elemento radioattivo si legava ai trasportatori di serotonina, hanno dimostrato che la curva dose-risposta tra SSRI e trasportatori di serotonina, è conforme alla tipica relazione iperbolica, che nasce come una conseguenza della legge dell’azione di massa. (figura 3) La funzione più adatta per rappresentare graficamente la curva dose-risposta, corrispondente ad un’equazione di Michaelis-Menten, (68) può essere usata per derivare valori per l’inibizione percentuale del trasportatore della serotonina (SERT) con diversi dosaggi di citalopram. (figura 3, tabella 2) (60)In particolare, l’inibizione del trasportatore della serotonina diminuisce bruscamente per le dosi inferiori al dosaggio terapeutico minimo degli SSRI
Pertanto è probabile che i metodi di scalaggio con riduzioni lineari della dose causeranno reazioni di astinenza sempre più severe con l’andare del tempo, poiché la riduzione del blocco del trasportatore della serotonina aumenta sempre più. (figura 4A).
Ad esempio, riduzioni della dose di citalopram di 5 mg. alla volta, partendo da una dose di 20 mg produrranno iperbolicamente diminuzioni sempre maggiori dell’inibizione del trasportatore della serotonina: si ha una riduzione assoluta dell’inibizione del trasportatore di serotonina del 3% passando da 20 mg a 15 mg, del 6% da 15 mg a 10 mg, del 13% da 10 mg a 5 mg e del 58% da 5 mg a 0 mg. Persino una riduzione da 2,5 mg (un quarto della più piccola compressa disponibile) a zero produrrà una riduzione assoluta dell’inibizione del trasportatore della serotonina del 42,9%, e una riduzione da 1,25 mg (un ottavo di una compressa) a zero produrrà una riduzione del 28% (maggiore del passaggio da 40 mg a 5 mg, che produce una riduzione del 27,3%). Queste notevoli riduzioni dell’inibizione potrebbero spiegare l’insuccesso dei precedenti tentativi di riduzione progressiva, (39,40) e in particolare le difficoltà con i sintomi di astinenza che i pazienti hanno verso la fine del loro scalaggio, con le dosi più basse. (14,36)
Per produrre una riduzione lineare dell’effetto farmacologico, è necessario un modello iperbolicamente decrescente della dose (figura 4B). Invece di ridurre la dose di quantità fisse, questa deve essere ridotta seguendo intervalli fissi di effetto biologico, ad esempio, riduzioni del 10% dell’occupazione del trasportatore di serotonina (le riduzioni del 20% sono mostrate nella figura 4B). Uno schema di scalaggio che produce riduzioni del 10% circa nell’occupazione del recettore della serotonina ad ogni riduzione della dose di citalopram sarebbe: 20 mg, 9,1 mg, 5,4 mg, 3,4 mg, 2,3 mg, 1,5 mg, 0,8 mg, 0,4 mg e 0 mg (tabella 2). Ulteriori esempi di riduzione di SSRI sono riportati nell’appendice. Questi schemi consentono un’applicazione farmacologicamente corretta dei principi di sospensione descritti sopra (“fermati lentamente man mano che scendi “). (1,49) Gli schemi di riduzione descritti in precedenza usano dosi simili a quelle che sono state usate con successo in studi con le “strisce per la riduzione” (tapering strips) (14) e in casi di persone con sindrome da astinenza “difficile”. (36)
Limitazioni
Esistono delle potenziali limitazioni nell’interpretazione della curva dose-risposta dello studio realizzato con la PET citato in precedenza. (60) Il numero di partecipanti in ciascun gruppo è relativamente piccolo e ciò forse ne limita la capacità di rilevare variazioni individuale. Tuttavia, la forma iperbolica della curva dose-risposta dovrebbe essere la stessa per ogni individuo, suggerendo che schemi iperbolici di riduzione della dose dovrebbero essere universalmente applicabili.
Gli SSRI potrebbero anche esercitare effetti neurotrofici, antinfiammatori e neuroendocrini; (61,62) tuttavia, si ritiene che questi siano a valle degli effetti sul trasportatore della serotonina e conseguenti alle modifiche nel sistema serotoninergico, (59,61,62) che indicano che l’occupazione del trasportatore di serotonina è verosimilmente un indicatore chiave della risposta biologica agli SSRI.
È difficile determinare se l’inibizione del trasportatore della serotonina corrisponderà in modo lineare agli effetti dell’astinenza. Il legame con il trasportatore della serotonina è correlato all’effetto antidepressivo degli SSRI; è stato dimostrato che la proporzione del legame con il trasportatore della serotonina tra le regioni terminali e il nucleo mediano del rafe è un predittore della risposta al trattamento con SSRI. (69) È teoricamente possibile che sia necessario superare una soglia minima di inibizione del trasportatore della serotonina prima che si osservi un effetto clinico, e che con livelli inferiori si abbiano effetti minimi; (60) questo potrebbe anche corrispondere a quanto accade con i sintomi dell’astinenza. Tuttavia, gli effetti dell’astinenza da altri farmaci non presentano un effetto soglia, (45,48) e sintomi di astinenza sono stati osservati a molti dosaggi diversi durante lo scalaggio degli SSRI, (9,35)suggerendo che la sospensione è probabilmente un’entità continua. Inoltre, esiste una relazione iperbolica tra dose di SSRI e riduzione dell’umore depresso, come mostrato in una mega-analisi; (70) una relazione iperbolica è stata anche dimostrata tra dose di SSRI e rischio di sintomi di astinenza. (55) Questi risultati indicano che la relazione iperbolica tra dose e inibizione del trasportatore della serotonina potrebbe anche estendersi agli effetti di astinenza, suggerendo che l’inibizione del trasportatore di serotonina potrebbe essere all’incirca correlata linearmente con gli effetti della sospensione.
Un’altra potenziale limitazione nell’interpretazione della curva dose-risposta di Meyer e colleghi (60) è che l’occupazione del trasportatore della serotonina è stata misurata nello striato, e questa misura potrebbe non avere rilevanza diretta con le azioni antidepressive. Tuttavia, questo e un successivo studio PET (71) hanno mostrato che gli SSRI causano una simile inibizione del trasportatore della serotonina nelle regioni cerebrali importanti per l’effetto degli SSRI (ad es. giro cingolato, amigdala e nuclei del rafe), con una simile relazione iperbolica tra dose di SSRI e occupazione del trasportatore della serotonina in tutte le regioni esaminate. (71) Pertanto, sembra ragionevole concludere che gli SSRI, come la maggior parte degli agenti farmacologici, hanno una relazione iperbolica tra dose ed effetti biologici e che ciò potrebbe essere importante per trovare schemi razionali per sospenderne l’uso.
Applicazione pratica della riduzione iperbolica della dose
È probabile che vi siano differenze individuali nelle esperienze degli effetti dell’astinenza da SSRI. (3) Pensiamo che uno schema personalizzato per la sospensione potrebbe essere trovato attuando una riduzione iniziale “di prova” della dose di SSRI che determini una diminuzione del 10% della occupazione del trasportatore della serotonina (o anche del 5% per essere prudenti), con successivo monitoraggio della gravità e della durata dei sintomi di astinenza. Suggeriamo una riduzione iniziale del 10% dell’occupazione del trasportatore della serotonina perché ciò corrisponderebbe all’incirca al dimezzamento della dose minima terapeutica (ad esempio, da 20 mg a 10 mg di citalopram), che è ben tollerata dalla maggior parte dei pazienti. Se il punteggio sulla checklist dei “Segni e Sintomi di Sospensione” dovesse tornare ai valori basali un mese dopo la riduzione iniziale, potrebbe essere consigliato una riduzione di dose mensile che comporti ogni volta una diminuzione del 10% dell’occupazione del trasportatore della serotonina. Questo processo dovrebbe essere soggetto a monitoraggio continuo, e il tasso di riduzione adeguato alla tolleranza del paziente. Il SSRI deve essere scalato in modo tale che il passo finale per la riduzione finale a zero sia uguale (o inferiore) all’entità dell’ultima riduzione precedentemente tollerata dal paziente. Ciò dovrebbe avvenire quando la dose di SSRI determina circa il 10% di occupazione del trasportatore della serotonina. Segnatamente, questa sarà una dose molto piccola, ad es. 0,4 mg per il citalopram. Tuttavia, gli studi hanno riportato che gli schemi di riduzione hanno avuto successo solo quando si arriva a utilizzare dosi simili di SSRI. (14,36) L’uso di formulazioni liquide di SSRI (in gocce) potrebbe essere necessario per raggiungere queste piccole dosi.
È difficile stabilire l’intervallo di tempo ottimale tra le riduzioni della dose. In assenza di studi che valutano la velocità con cui può verificarsi il neuroadattamento, diversi aspetti possono fornire una guida. Per tutti gli SSRI ad eccezione della fluoxetina, le proprietà farmacocinetiche prevedono che essi raggiungeranno lo steady state tra 5 giorni e 14 giorni dopo la riduzione della dose (tabella 3). (72) Come indicato sopra, sono stati rilevati sintomi di astinenza nei pazienti per periodi di tempo variabili, da alcuni giorni, (9) a settimane o mesi (18,21-23,73,74) e, in alcuni casi, per più di un anno. (21,22,73,74) Queste evidenze sono stati generalmente ricavate da pazienti che interrompono bruscamente i farmaci; è possibile che con riduzioni più caute, i sintomi di sospensione durino per periodi più brevi. Gli effetti clinici degli SSRI possono manifestarsi con alcune settimane di ritardo dopo che se ne iniziato l’uso, (59,70) mentre gli effetti collaterali si manifestano dopo giorni. (75) Non è chiaro se i sintomi di astinenza possano seguire il modello temporale degli effetti antidepressivi o degli effetti collaterali. Potrebbe essere prudente attendere 4 settimane dopo una riduzione del SSRI per osservare se vi siano effetti di astinenza ritardati. Ciò consentirebbe anche l’osservazione della eventuale ricomparsa dei sintomi della depressione a seguito della riduzione della dose di SSRI. Tuttavia, la migliore guida potrebbe essere l’intervallo richiesto affinché il punteggio della checklist dei “Segni e Sintomi di Sospensione” del paziente ritorni al valore basale dopo una riduzione della dose.
Altri determinanti dei sintomi di astinenza da SSRI
È probabile che altre caratteristiche di farmaci e pazienti influenzino la gravità delle sindromi da astinenza da SSRI. La paroxetina e la fluoxetina sono entrambe metabolizzate dal citocromo P450 2D6 e inibiscono il proprio metabolismo, determinando una cinetica non lineare. (76) Questo determina una riduzione sproporzionata delle concentrazioni plasmatiche durante l’interruzione del farmaco. Sebbene questo effetto potrebbe non essere clinicamente significativo per la fluoxetina a causa della sua lunga emivita, è probabile che sia significativo per la paroxetina. (47) La paroxetina potrebbe produrre una sindrome da astinenza più grave rispetto ad altri SSRI perché ha pronunciati effetti antagonisti muscarinici e moderati effetti inibitori sul trasportatore della norepinefrina. (47,63) È anche probabile che alcuni fattori del paziente, come la presenza di diversi enzimi del citocromo, la sensibilità del trasportatore della serotonina all’inibizione e fattori psicologici, possano contribuire al rischio di sintomi di astinenza. Un’ulteriore comprensione di questi fattori e il dosaggio dei livelli plasmatici di SSRI, potrebbero essere utili per predisporre schemi di riduzione personalizzati.
Conseguenze pratiche della riduzione iperbolica della dose
Il modello sopraindicato risolve un’incertezza spesso evidenziata dai pazienti e dai medici curanti, ovvero se usare una strategia di “micro riduzione” (micro-taper) o di “mini riduzione” (mini-taper). La micro riduzione comporta decrementi minuscoli del SSRI ogni giorno o settimana. La mini riduzione si basa su decrementi più ampi e graduali, con intervalli più lunghi tra i decrementi (generalmente di settimane). La mini riduzione appare più sensibile della micro riduzione. È stato segnalato che i sintomi di astinenza durano per diverse settimane (o più) dopo l’interruzione del trattamento in un grande numero di pazienti. (9,13) Di conseguenza la micro riduzione presenta la possibilità di effetti di astinenza cumulativi poiché sovrapposti gli uni agli altri. Questo processo rende difficile stabilire quale riduzione (o insieme di riduzioni) sia responsabile dei sintomi riscontrati. Sembra quindi prudente dopo aver ridotto la dose del farmaco, lasciar trascorrere un periodo di tempo significativo mentre gli effetti dell’astinenza si risolvono, prima di passare al successivo decremento.
Fluoxetina
È stata suggerita la sostituzione di SSRI a breve emivita con la fluoxetina come strategia per evitare i sintomi gravi di astinenza. (3,77) La fluoxetina è stata regolarmente riconosciuta come causa di effetti di astinenza meno gravi rispetto ad altri SSRI, e ciò è stato attribuito alla sua emivita più lunga. (3,29,77) La fluoxetina impiega 35-75 giorni per raggiungere una concentrazione plasmatica stabile (steady state), (47) e ciò è probabilmente la causa delle osservazioni secondo cui i suoi sintomi di astinenza possono insorgere settimane dopo l’interruzione. (9,56) Pertanto, sarebbe prudente attendere 3 mesi (35-75 giorni più 4 settimane) per osservare i sintomi di astinenza tardivi. Data questa proprietà della fluoxetina, che è un po’ come un meccanismo integrato per la riduzione, potrebbe essere ragionevole ridurre le dosi in modo che si determini ad ogni riduzione circa il 30% di diminuzione nell’occupazione del trasportatore della serotonina, calibrandola in base alla tolleranza del paziente.
Tuttavia, dovremmo diffidare dell’idea che la fluoxetina sia auto-riducente e possa quindi essere interrotta bruscamente o rapidamente, come suggeriscono le linee guida. (29,78) Sebbene il suo profilo farmacocinetico preveda un declino graduale del livello plasmatico, un breve periodo di riduzione (ad es. per 2 settimane) (27)potrebbe costituire uno schema di scalaggio rapido che va oltre il 10% di riduzione dell’effetto biologico al mese.
Orientamenti futuri per la ricerca
Abbiamo proposto un metodo basato sulla ricerca farmacologica per la riduzione del trattamento con SSRI, la cui validità dovrebbe essere valutata mediante studi randomizzati controllati (RCT). I nomogrammi di sospensione che aggregano la variazione delle risposte alla sospensione potrebbero guidare i passi dello scalaggio (figura 5). Determinanti del rischio, come il livello di SSRI nel plasma, lo stato degli enzimi del citocromo, la misurazione PET dell’occupazione del trasportatore della serotonina e altri fattori genetici, metabolici e psicologici, potrebbero essere incorporati nel nomogramma man mano che i loro effetti vengono chiariti. Anche i mezzi farmacologici e non farmacologici per migliorare la tollerabilità della riduzione di SSRI vanno inclusi nella ricerca. Interventi psicologici, come la terapia cognitiva preventiva e altri approcci cognitivo comportamentali, sono stati individuati per ridurre il rischio di recidiva nei pazienti con depressione ricorrente e in coloro che riducono i loro antidepressivi. (39,40)
Suggeriamo che, in assenza di prove più solide per accompagnare la riduzione (specialmente laddove le linee guida consigliano di ridurre gradualmente senza istruzioni specifiche), il regime di riduzione qui descritto dovrebbe essere considerato per l’adozione nella pratica clinica. Ci sono pochi svantaggi nel raccomandare riduzioni più lente. (29)Dovrebbe essere almeno riconosciuto che i periodi di riduzione di 2-4 settimane sono probabilmente inadeguati per ridurre i sintomi di astinenza per molti pazienti, e che periodi più lunghi di riduzione e schemi che includono dosi più basse di farmaci, hanno più probabilità di essere efficaci. È urgentemente necessario un ulteriore studio empirico sui programmi di riduzione, incluso quello qui proposto, con un conseguente aggiornamento delle linee guida.
Autori
MAH ha concepito l’idea del manoscritto, ha scritto il manoscritto e disegnato le figure. DT ha contribuito a sviluppare l’idea, ha rivisto e curato il manoscritto.
Conflitto di interessi
MAH dichiara l’assenza di confilitti di interessi. DT ha ricevuto contributi da Lundbeck e da Janssen, non correlati con questo articolo.
Bibliografia
1 Bain KT, Holmes HM, Beers MH, Maio V, Handler SM, Pauker SG. Discontinuing medications: a novel approach for revising the prescribing stage of the medication-use process. J Am Geriatr Soc 2008; 56: 1946–52.
2 Howland RH. Potential adverse effects of discontinuing psychotropic drugs: part 2: antidepressant drugs. J Psychosoc Nurs Ment Health Serv 2010; 48: 9–12.
3 Haddad PM, Anderson IM. Recognising and managing antidepressant discontinuation symptoms. Adv Psychiatr Treat 2007; 13: 447–57.
4 Schatzberg AF, Haddad P, Kaplan EM, et al. Serotonin reuptake inhibitor discontinuation syndrome: a hypothetical definition. Discontinuation Consensus panel. J Clin Psychiatry 1997; 58 (suppl 7): 5–10.
5 American Psychiatric Association. The diagnostic and statistical manual of mental disorders, 5th edn. Arlington, VA: American Psychiatric Publishing, 2013.
6 Rosenbaum JF, Fava M, Hoog SL, Ascroft RC, Krebs WB. Selective serotonin reuptake inhibitor discontinuation syndrome: a randomized clinical trial. Biol Psychiatry 1998; 44: 77–87.
7 Warner CH, Bobo W, Warner C, Reid S, Rachal J. Antidepressant discontinuation syndrome. Am Fam Physician 2006; 74: 449–56.
8 Shelton RC. Steps following attainment of remission: discontinuation of antidepressant therapy. Prim Care Companion J Clin Psychiatry 2001; 3: 168–74.
9 Fava GA, Gatti A, Belaise C, Guidi J, Offidani E. Withdrawal symptoms after selective serotonin reuptake inhibitor discontinuation: a systematic review. Psychother Psychosom 2015; 84: 72–81.
10 Black K, Shea C, Dursun S, Kutcher S. Selective serotonin reuptake inhibitor discontinuation syndrome: proposed diagnostic criteria. J Psychiatry Neurosci 2000; 25: 255–61.
11 Young A, Haddad P. Discontinuation symptoms and psychotropic drugs. Lancet 2000; 355: 1184.
12 Cleare A, Pariante CM, Young AH, et al. Evidence-based guidelines for treating depressive disorders with antidepressants: a revision of the 2008 British Association for Psychopharmacology guidelines. J Psychopharmacol 2015; 29: 459–525.
13 Davies J, Read J. A systematic review into the incidence, severity and duration of antidepressant withdrawal effects: are guidelines evidence-based? Addict Behav 2018; published online Sept 4. DOI:10.1016/j.addbeh.2018.08.027 (preprint).
14 Groot PC, van Os J. Antidepressant tapering strips to help people come off medication more safely. Psychosis 2018; 10: 142–45.
15 Bogetto F, Bellino S, Revello RB, Patria L. Discontinuation syndrome in dysthymic patients treated with selective serotonin reuptake inhibitors: a clinical investigation. CNS Drugs 2002; 16: 273–83.
16 Tint A, Haddad PM, Anderson IM. The effect of rate of antidepressant tapering on the incidence of discontinuation symptoms: a randomised study. J Psychopharmacol 2008; 22: 330–32.
17 Hindmarch I, Kimber S, Cockle SM. Abrupt and brief discontinuation of antidepressant treatment: effects on cognitive function and psychomotor performance. Int Clin Psychopharmacol 2000; 15: 305–18.
18 Royal College of Psychiatrists. Coming off antidepressants. 2012. www.rcpsych.ac.uk/healthadvice/treatmentswellbeing/antidepressants/comingoffantidepressants.aspx (accessed March 1, 2018).
19 Bosman RC, Huijbregts KM, Verhaak PF, et al. Long-term antidepressant use: a qualitative study on perspectives of patients and GPs in primary care. Br J Gen Pract 2016; 66: e708–19.
20 Valuck RJ, Orton HD, Libby AM. Antidepressant discontinuation and risk of suicide attempt. J Clin Psychiatry 2009; 70: 1069–77.
21 Davies J, Regina P, Montagu L. Antidepressant withdrawal: a survey of patients’ experience by the All-Party Parliamentary Group for Prescribed Drug Dependence. 2018. http://prescribeddrug.org/wpcontent/uploads/2018/10/APPG-PDD-Survey-of-antidepressantwithdrawal-experiences.pdf (accessed Nov 1, 2018).
22 Fava GA, Bernardi M, Tomba E, Rafanelli C. Effects of gradual discontinuation of selective serotonin reuptake inhibitors in panic disorder with agoraphobia. Int J Neuropsychopharmacol 2007; 10: 835–38.
23 Bhanji NH, Chouinard G, Kolivakis T, Margolese HC. Persistent tardive rebound panic disorder, rebound anxiety and insomnia following paroxetine withdrawal: a review of reboundwithdrawal phenomena. Can J Clin Pharmacol 2006; 13: e69–74.
24 Johnson CF, Macdonald HJ, Atkinson P, Buchanan AI, Downes N, Dougall N. Reviewing long-term antidepressants can reduce drug burden: a prospective observational cohort study. Br J Gen Pract 2012; 62: 773–79.
25 Eveleigh R, Muskens E, Lucassen P, et al. Withdrawal of unnecessary antidepressant medication: a randomised controlled trial in primary care. BJGP Open 2017; 34: bjgpopen17X101265.
26 NICE. Depression in adults: recognition and management (CG90). London: National Institute for Health and Care Excellence, 2009.
27 MIMS. Antidepressants, a guide to switching and withdrawing. http://www.mims.co.uk/Tables/882430/Switching-Antidepressants/ (accessed Nov 1, 2018).
28 Hirsch M, Birnbaum RJ. Antidepressant medication in adults: switching and discontinuing medication. https://www.uptodate. com/contents/discontinuing-antidepressant-medications-in-adults (accessed Feb 11, 2019).
29 Ogle NR, Akkerman SR. Guidance for the discontinuation or switching of antidepressant therapies in adults. J Pharm Pract 2013; 26: 389–96.
30 Baldwin DS, Cooper JA, Huusom AKT, Hindmarch I. A double-blind, randomized, parallel-group, flexible-dose study to evaluate the tolerability, efficacy and effects of treatment discontinuation with escitalopram and paroxetine in patients with major depressive disorder. Int Clin Psychopharmacol 2006; 21: 159–69.
31 Montgomery SA, Kennedy SH, Burrows GD, Lejoyeux M, Hindmarch I. Absence of discontinuation symptoms with agomelatine and occurrence of discontinuation symptoms with paroxetine: a randomized, double-blind, placebo-controlled discontinuation study. Int Clin Psychopharmacol 2004; 19: 271–80.
32 Phelps J. Tapering antidepressants: is 3 months slow enough? Med Hypotheses 2011; 77: 1006–08.
33 Himei A, Okamura T. Discontinuation syndrome associated with paroxetine in depressed patients: a retrospective analysis of factors involved in the occurrence of the syndrome. CNS Drugs 2006; 20: 665–72.
34 van Geffen EC, Hugtenburg JG, Heerdink ER, van Hulten RP, Egberts AC. Discontinuation symptoms in users of selective serotonin reuptake inhibitors in clinical practice: tapering versus abrupt discontinuation. Eur J Clin Pharmacol 2005; 61: 303–07.
35 Murata Y, Kobayashi D, Imuta N, et al. Effects of the serotonin 1A, 2A, 2C, 3A, and 3B and serotonin transporter gene polymorphisms on the occurrence of paroxetine discontinuation syndrome. J Clin Psychopharmacol 2010; 30: 11–17.
36 Amsden GW, Georgian F. Orthostatic hypotension induced by sertraline withdrawal. Pharmacotherapy 1996; 16: 684–86.
37 Dominguez RA, Goodnick PJ. Adverse events after the abrupt discontinuation of paroxetine. Pharmacotherapy 1995; 15: 778–80.
38 Benazzi F. Venlafaxine withdrawal symptoms. Can J Psychiatry 1996; 41: 487.
39 Bockting CLH, Klein NS, Elgersma HJ, et al. Effectiveness of preventive cognitive therapy while tapering antidepressants versus maintenance antidepressant treatment versus their combination in prevention of depressive relapse or recurrence (DRD study): a three-group, multicentre, randomised controlled trial. Lancet Psychiatry 2018; 5: 401–10.
40 Scholten WD, Batelaan NM, van Oppen P, et al. The efficacy of a group CBT relapse prevention program for remitted anxiety disorder patients who discontinue antidepressant medication: a randomized controlled trial. Psychother Psychosom 2018; 87: 240–42.
41 Baldessarini RJ, Tondo L, Ghiani C, Lepri B. Illness risk following rapid versus gradual discontinuation of antidepressants. Am J Psychiatry 2010; 167: 934–41.
42 Maixner SM, Greden JF. Extended antidepressant maintenance and discontinuation syndromes. Depress Anxiety 1998; 8 (suppl 1): 43–53.
43 Turton S, Lingford-Hughes A. Neurobiology and principles of addiction and tolerance. Medicine (Baltimore) 2016; 44: 693–96.
44 Dilsaver SC. Withdrawal phenomena associated with antidepressant and antipsychotic agents. Drug Saf 1994; 10: 103–14.
45 Ashton H. The diagnosis and management of benzodiazepine dependence. Curr Opin Psychiatry 2005; 18: 249–55.
46 Hodding GC, Jann M, Ackerman IP. Drug withdrawal syndromes: a literature review. West J Med 1980; 133: 383–91.
47 Olver JS, Burrows GD, Norman TR. Discontinuation syndromes with selective serotonin reuptake inhibitors: are there clinically relevant differences? CNS Drugs 1999; 12: 171–77.
48 Lader M, Tylee A, Donoghue J. Withdrawing benzodiazepines in primary care. CNS Drugs 2009; 23: 19–34.
49 Brett J, Murnion B. Management of benzodiazepine misuse and dependence. Aust Prescr 2015; 38: 152–55.
50 Chou TC, Talalay P. Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regul 1984; 22: 27–55.
51 Brouillet E, Chavoix C, Bottlaender M, et al. In vivo bidirectional modulatory effect of benzodiazepine receptor ligands on GABAergic transmission evaluated by positron emission tomography in non-human primates. Brain Res 1991; 557: 167–76.
52 Ashton H. The treatment of benzodiazepine dependence. Addiction 1994; 89: 1535–41.
53 Weller IVD, Ashby D, Brook R, et al. Report of the CSM Expert Working Group on the safety of selective serotonin reuptake inhibitors. London: Medicines and Healthcare Products Regulatory Agency, 2005.
54 Perahia DG, Kajdasz DK, Desaiah D, Haddad PM. Symptoms following abrupt discontinuation of duloxetine treatment in patients with major depressive disorder. J Affect Disord 2005; 89: 207–12.
55 Michelson D, Fava M, Amsterdam J, et al. Interruption of selective serotonin reuptake inhibitor treatment. Double-blind, placebo-controlled trial. Br J Psychiatry 2000; 176: 363–68.
56 Zajecka J, Fawcett J, Amsterdam J, et al. Safety of abrupt discontinuation of fluoxetine: a randomized, placebo-controlled study. J Clin Psychopharmacol 1998; 18: 193–97.
57 Henry ME, Moore CM, Kaufman MJ, et al. Brain kinetics of paroxetine and fluoxetine on the third day of placebo substitution: a fluorine MRS study. Am J Psychiatry 2000; 157: 1506–08.
58 Yasui-Furukori N, Hashimoto K, Tsuchimine S, Tomita T. Characteristics of escitalopram discontinuation syndrome: a preliminary study. Clin Neuropharmacol 2016; 39: 125–27.
59 Stahl SM. Mechanism of action of serotonin selective reuptake inhibitors. Serotonin receptors and pathways mediate therapeutic effects and side effects. J Affect Disord 1998; 51: 215–35.
60 Meyer JH, Wilson AA, Sagrati S, et al. Serotonin transporter occupancy of five selective serotonin reuptake inhibitors at different doses: an [11C]DASB positron emission tomography study. Am J Psychiatry 2004; 161: 826–35.
61 Malberg JE, Schechter LE. Increasing hippocampal neurogenesis: a novel mechanism for antidepressant drugs. Curr Pharm Des 2005; 11: 145–55.
62 Janssen DG, Caniato RN, Verster JC, Baune BT. A psychoneuroimmunological review on cytokines involved in antidepressant treatment response. Hum Psychopharmacol 2010; 25: 201–15.
63 Renoir T. Selective serotonin reuptake inhibitor antidepressant treatment discontinuation syndrome: a review of the clinical evidence and the possible mechanisms involved. Front Pharmacol 2013; 4: 45.
64 Wamsley JK, Byerley WF, McCabe RT, McConnell EJ, Dawson TM, Grosser BI. Receptor alterations associated with serotonergic agents: an autoradiographic analysis. J Clin Psychiatry 1987; 48 (suppl): 19–25.
65 Meyer J, Kapur S, Eisfeld B, et al. The effect of paroxetine on 5-HT(2A) receptors in depression: an [(18)F]setoperone PET imaging study. Am J Psychiatry 2001; 158: 78–85.
66 Haahr ME, Fisher PM, Jensen CG, et al. Central 5-HT4 receptor binding as biomarker of serotonergic tonus in humans: a [11C]SB207145 PET study. Mol Psychiatry 2014; 19: 427–32.
67 Mawe GM, Hoffman JM. Serotonin signalling in the gut: functions, dysfunctions and therapeutic targets. Nat Rev Gastroenterol Hepatol 2013; 10: 473–86.
68 Atkins GL, Nimmo IA. A comparison of seven methods for fitting the Michaelis-Menten equation. Biochem J 1975; 149: 775–77.
69 Lanzenberger R, Kranz GS, Haeusler D, et al. Prediction of SSRI treatment response in major depression based on serotonin transporter interplay between median raphe nucleus and projection areas. Neuroimage 2012; 63: 874–81.
70 Hieronymus F, Nilsson S, Eriksson E. A mega-analysis of fixed-dose trials reveals dose-dependency and a rapid onset of action for the antidepressant effect of three selective serotonin reuptake inhibitors. Transl Psychiatry 2016; 6: e834.
71 Baldinger P, Kranz GS, Haeusler D, et al. Regional differences in SERT occupancy after acute and prolonged SSRI intake investigated by brain PET. Neuroimage 2014; 88: 252–62.
72 Hiemke C, H.rtter S. Pharmacokinetics of selective serotonin reuptake inhibitors. Pharmacol Ther 2000; 85: 11–28.
73 Stockmann T, Odegbaro D, Timimi S, Moncrieff J. SSRI and SNRI withdrawal symptoms reported on an internet forum. Int J Risk Saf Med 2018; 29: 175–80.
74 Belaise C, Gatti A, Chouinard VA, Chouinard G. Patient online report of selective serotonin reuptake inhibitor-induced persistent postwithdrawal anxiety and mood disorders. Psychother Psychosom 2012; 81: 386–88.
75 Ferguson JM. SSRI antidepressant medications: adverse effects and tolerability. Prim Care Companion J Clin Psychiatry 2001; 3: 22–27.
76 Preskorn SH. Clinically relevant pharmacology of selective serotonin reuptake inhibitors. An overview with emphasis on pharmacokinetics and effects on oxidative drug metabolism. Clin Pharmacokinet 1997; 32 (suppl 1): 1–21.
77 Schatzberg AF, Blier P, Delgado PL, Fava M, Haddad PM, Shelton RC. Antidepressant discontinuation syndrome: consensus panel recommendations for clinical management and additional research. J Clin Psychiatry 2006; 67 (suppl 4): 27–30.
78 Perahia DG, Quail D, Desaiah D, Corruble E, Fava M. Switching to duloxetine from selective serotonin reuptake inhibitor antidepressants: a multicenter trial comparing 2 switching techniques. J Clin Psychiatry 2008; 69: 95–105.